Resumen
Objetivo: En los granulomas periapicales, los plasmocitos (PL) participan activamente mediante la liberación de inmunoglobulinas. El propósito de este ensayo fue identificar y contar el número de PL en diferentes períodos de tiempo en lesiones periapicales experimentales en ratas.
Materiales y métodos: Mediante la exposición al medio oral de la pulpa de los primeros molares inferiores izquierdos, se indujeron granulomas periapicales en ratas a las
que previamente se les suministró anestesia. La pulpa de los primeros molares inferiores derechos no fue expuesta, y estos dientes se utilizaron como control. Los animales fueron eutanasiados a los 10, 30 y 60 días de la exposición. Los maxilares inferiores fueron removidos, y los primeros molares, junto con los tejidos circundantes, se procesaron para su estudio histológico. Se obtuvieron secciones semiseriadas, posteriormente coloreadas con verde de metilo-pironina (VMP).
Cada tres secciones, las tres siguientes fueron coloreadas con hematoxilina y eosina (H-E). Los controles también fueron coloreados con H-E.
Resultados: Todos los especímenes experimentales coloreados con H-E revelaron la presencia de granulomas periapicales.
Luego de la exposición pulpar, el número de PL que reaccionó positivamente al VMP se incrementó de manera progresiva desde el día 10 hasta los días 30 y 60. A pesar
de que a los 60 días el número de PL fue ligeramente menor que a los 30 días, no hubo diferencias estadísticamente significativas entre estos dos períodos. Los especímenes del grupo control coloreados con H-E mostraron que los tejidos periapicales se encontraban dentro de los parámetros normales en
todos los períodos de observación.
Conclusiones: Los resultados de este estudio revelaron que el número de plasmocitos VMP positivos se incrementa progresivamente en función del tiempo transcurrido pero se estabiliza al finalizar el experimento. También sugieren que el empleo de la coloración de VMP es un procedimiento adecuado para la identificación y la cuantificación de plasmocitos en los granulomas periapicales inducidos experimentalmente en ratas.
Palabras clave: Células inflamatorias, células plasmáticas, granuloma periapical, rata.
", "sameAs": "https://doi.org/10.52979/raoa.1099", "about": [ "Works", "Catalog" ], "pageEnd": "41", "pageStart": "48", "name": "Detección y cuantificación de células plasmáticas (plasmocitos) en granulomas periapicales inducidos experimentalmente en ratas", "author":[ "Osvaldo Zmener" , "Cornelis H. Pameijer" , "Ana Clara Cotrozo" ] } ] }Autor/es: Osvaldo Zmener, Cornelis H. Pameijer, Ana Clara Cotrozo
Vol: 109 | Nº 1 | Abr 2021 | Páginas: 41-48
Presentado: 03/05/2020 | Aceptado: 04/12/2020 | Publicado: 15/04/2021
DOI: https://doi.org/10.52979/raoa.1099 copiar
PDF | Citar este artículo | Volver
X Twitter | WhatsApp | Facebook | E-mail
INVESTIGACIÓN - ENDODONCIA
Detección y cuantificación de células plasmáticas (plasmocitos) en granulomas periapicales inducidos experimentalmente en ratas
Detection and quantification of plasma cells in experimentally induced rat periapical granulomas
Presentado: 3 de mayo de 2020
Aceptado: 4 de diciembre de 2020
 Cornelis H. Pameijer(2)
Cornelis H. Pameijer(2)  Ana Clara Cotrozo(1)
Ana Clara Cotrozo(1) 
Resumen
Objetivo: En los granulomas periapicales, los plasmocitos (PL) participan activamente mediante la liberación de inmunoglobulinas. El propósito de este ensayo fue identificar y contar el número de PL en diferentes períodos de tiempo en lesiones periapicales experimentales en ratas.
Materiales y métodos: Mediante la exposición al medio oral de la pulpa de los primeros molares inferiores izquierdos, se indujeron granulomas periapicales en ratas a las que previamente se les suministró anestesia. La pulpa de los primeros molares inferiores derechos no fue expuesta, y estos dientes se utilizaron como control. Los animales fueron eutanasiados a los 10, 30 y 60 días de la exposición. Los maxilares inferiores fueron removidos, y los primeros molares, junto con los tejidos circundantes, se procesaron para su estudio histológico. Se obtuvieron secciones semiseriadas, posteriormente coloreadas con verde de metilo-pironina (VMP).
Cada tres secciones, las tres siguientes fueron coloreadas con hematoxilina y eosina (H-E). Los controles también fueron coloreados con H-E.
Resultados: Todos los especímenes experimentales coloreados con H-E revelaron la presencia de granulomas periapicales.
Luego de la exposición pulpar, el número de PL que reaccionó positivamente al VMP se incrementó de manera progresiva desde el día 10 hasta los días 30 y 60. A pesar de que a los 60 días el número de PL fue ligeramente menor que a los 30 días, no hubo diferencias estadísticamente significativas entre estos dos períodos. Los especímenes del grupo control coloreados con H-E mostraron que los tejidos periapicales se encontraban dentro de los parámetros normales en todos los períodos de observación.
Conclusiones: Los resultados de este estudio revelaron que el número de plasmocitos VMP positivos se incrementa progresivamente en función del tiempo transcurrido pero se estabiliza al finalizar el experimento. También sugieren que el empleo de la coloración de VMP es un procedimiento adecuado para la identificación y la cuantificación de plasmocitos en los granulomas periapicales inducidos experimentalmente en ratas.
Palabras clave: Células inflamatorias, células plasmáticas, granuloma periapical, rata.
Abstract
Aim: Plasma cells (PL) release immunoglobulin in periapical lesions. The purpose of this assay was to identify and count the number of plasmocytes observed in periapical lesions in rats.
Materials and methods: By exposing the pulp of the lower left first molars to the oral environment, periapical granulomas were induced in rats previously anesthetized. The pulp of right mandibular first molars was not exposed and these teeth were used as negative controls. The animals were euthanized at 10, 30 and 60 days after pup exposure. The mandibles were removed and specimens of the molar teeth along with the surrounding tissues were prepared for histology.
Semi serial sections of the left first molar were stained with methyl green pyronine (MGP). Every three sections, the following three sections were stained with hematoxilyn and eosin (H-E). Negative control samples were stained with H-E.
Results: All the H-E stained experimental samples revealed the presence of periapical granulomas. After pulp exposure, the number of PL increased from day 10 to 30 and 60. In the 60-day samples the number of PL was slightly less than that of the 30-day samples, with no statistically significant difference. The H-E stained control samples showed normal periapical tissues in all observation periods.
Conclusions: The results of this study revealed that the number of VMP positive PL, increased progressively with time but it was stabilized at the end of the experiment. In addition, the results suggest that the use of VMP stain is a suitable procedure for the identification and counting of PL in experimentally induced periapical granulomas in rats.
Key words: Inflammatory cells, periapical granuloma, plasma cells, rats.
Introducción
El granuloma periapical de origen endodóntico (GPE) es una de las lesiones inflamatorias más frecuentes en el tejido óseo periapical de los maxilares.(1)
Los GPE se generan como respuesta a la continua estimulación antigénica provocada por la invasión microbiana del sistema de conductos radiculares.(1-4)
La respuesta inflamatoria es comúnmente acompañada por la destrucción del tejido óseo circundante e incluso por la reabsorción cemento-dentinaria.(1)
Su desarrollo y su patogénesis han sido históricamente investigados por diferentes autores(1-4) y confirmados por investigaciones más recientes.(5,6)
En un estudio histológico realizado sobre 170 lesiones periapicales humanas removidas quirúrgicamente, (7) se comprobó que el 71,76% de la muestra estaba constituida por GPE, mientras que en el 28,23% restante las lesiones eran quistes u otro tipo de patología de origen no dentario. Las coloraciones de rutina tales como la hematoxilina y eosina (H-E) revelan que los GPE contienen una gran proporción de plasmocitos (PL), polimorfonucleares neutrófilos (PN), linfocitos (LF), macrófagos (MF), fibroblastos (FB), vasos sanguíneos (VS) y mastocitos (MC).(7,8)
Otras coloraciones específicas, tales como el verde de metilo-pironina (VMP),(8) permiten además identificar los ácidos nucleicos (DNA y RNA) y otras estructuras intracitoplasmáticas.
Los PL constituyen uno de los tipos celulares predominantes en los granulomas periapicales.(9) Estas células se originan en la médula; se localizan en los ganglios linfáticos, el bazo, el timo y el intestino, y se forman por diferenciación de los linfocitos B activados. Los PL participan activamente en la respuesta inmunológica del huésped mediante la liberación de inmunoglobulinas(3,10) (aproximadamente 10.000 por segundo), especialmente la IgE, cuyas características dependen de las señales que portan una serie de proteínas específicas (citoquinas) producidas por macrófagos o linfocitos.(11) En un trabajo anterior realizado en granulomas periapicales humanos,(8) se identificó una importante cantidad de PL activos en cuyo citoplasma se observó la presencia de estructuras esferoidales compatibles con cuerpos hialinos de Russell (CHR) cuya función se encuentra íntimamente ligada a la producción y la liberación de inmunoglobulinas.
Salvo en el caso específico de que los GPE hayan sido previamente obtenidos quirúrgicamente en la clínica, (8) , (12) no es factible realizar investigaciones de carácter experimental en humanos. Por esta razón, la literatura relacionada resulta pródiga en trabajos realizados en animales de laboratorio, especialmente en el tejido periapical de la rata, donde los GPE son fácilmente reproducibles y permiten ser investigados bajo diferentes condiciones experimentales.(13-18)
En ese sentido, se ha sugerido que el comportamiento de los tejidos periapicales de la rata es similar al de los humanos, razón por la que este modelo animal ha sido frecuentemente utilizado.(13-16) Xiong et al.(11) observaron que la concentración y la expresión de inmunoglobulinas y el número de células que participan en la respuesta inmune en GPE inducidos en ratas se incrementa paulatinamente entre los días 0 y 21, pero que a los 28 días la curva se detiene y se estabiliza.
El objetivo del presente ensayo in vivo fue cuantificar el número de PL presentes en diferentes períodos de tiempo luego de la formación de granulomas periapicales en ratas, con exposición del conducto radicular al medio bucal. Materiales y métodos El protocolo del presente ensayo fue aprobado por el Comité de Ética de la Asociación Odontológica Argentina (resolución n° 0320).
Preparación de los animales
Se utilizaron 24 (n=24) ratas Wistar hembra de ±300 g de masa. Los animales se trataron de acuerdo con las normas ISO 10993-1, 2018(19) e ISO 10993-2, 2018(20) y los principios éticos de experimentación y especificaciones para el cuidado y uso de animales de laboratorio.(21)
La anestesia fue realizada mediante la administración intraperitoneal de pentobarbital sódico (3 mg/kg). En cada rata, se accedió a la cámara pulpar de los primeros molares inferiores izquierdos (grupo experimental; E), a nivel del conducto distal, mediante una fresa redonda #1/2 (Dentsply-Maillefer, Ballaigues, Suiza). El acceso fue realizado en la fosa correspondiente a la raíz distal, profundizando ligeramente el tamaño total de la parte activa de la fresa y tomando la precaución de no ejercer presión lateral. Los primeros molares inferiores derechos no recibieron ningún tipo de procedimiento operatorio y se utilizaron como grupo control negativo (C). Las pulpas del grupo experimental se mantuvieron expuestas al medio oral durante diferentes períodos hasta que los animales fueron eutanasiados. Durante el ensayo, los animales fueron alojados en jaulas de acero inoxidable con agua potable y alimento balanceado ad libitum, con temperatura ambiental controlada (24 °C) y ciclos de luz/oscuridad de doce horas.
Se realizó la eutanasia en grupos de ocho (n=8) a los 10, 30 y 60 días posoperatorios mediante una sobredosis de anestesia.
Los maxilares fueron removidos quirúrgicamente y se fijaron durante 10 días en solución de Carnoy.(22)
Luego de la fijación se eliminaron los tejidos blandos circundantes y se obtuvieron imágenes de todos los maxilares (izquierdos y derechos) mediante un radiovisiógrafo Trophy Intel Duo Core 2GHz (Trophy, Marne-La-Vallée, Francia) con el objeto de confirmar la presencia/ausencia de áreas radiolúcidas periapicales. Posteriormente, se obtuvieron bloques óseos, cada uno de ellos con el primer molar inferior y los tejidos circundantes. Los bloques se descalcificaron a 4 °C, en EDTA al 10%, y se procesaron para su estudio histológico. Finalmente, se realizaron secciones longitudinales semiseriadas con orientación mesiodistal de aproximadamente 6 μm de espesor, tratando de involucrar la parte más central del tercio apical de la raíz y el área correspondiente a los tejidos periapicales. Las secciones obtenidas de los molares del grupo E fueron coloreadas con VMP. De cada tres secciones, las tres siguientes se colorearon con H-E. Las secciones correspondientes a los molares del grupo C también fueron coloreadas con H-E.
Evaluación
Las secciones histológicas pertenecientes a los tres períodos experimentales se observaron y fotografiaron mediante un fotomicroscopio (Carl Zeiss AG, Oberkochen, Alemania) equipado con una cámara digital Canon EOS SD M-IV (Canon, Tokio, Japón). Las imágenes fueron capturadas y analizadas por medio del programa Image Tool U.3 (University of Texas Health Center, San Antonio, TX, Estados Unidos).
En todas las muestras del grupo E, las secciones coloreadas con H-E confirmaron la presencia de GPE. Se tomó al azar una de las tres secciones más centrales de los granulomas coloreadas con VMP de todos los primeros molares experimentales y se determinaron tres áreas de 500 × 500 μm, consideradas como unidades de evaluación (UE) y ubicadas en la parte más central de cada sección. De esta forma se obtuvieron tres (n=3) UE por cada unidad experimental (rata), en las que se calculó el número de PL presentes. Las observaciones se realizaron a X400.
Se tomó como dato la media aritmética de los valores registrados en las tres UE correspondientes a cada animal. Finalmente, se obtuvieron la media aritmética y el desvío estándar de la suma de los promedios de la totalidad de UE de todos los especímenes correspondientes a cada período. Los resultados se expresaron como número final de PL. La comparación entre los valores registrados a los 10, 30 y 60 días (factor tiempo) fue realizada mediante la prueba no paramétrica de Kruskall-Wallis, complementada con comparaciones múltiples. El nivel de significación fue establecido en P<0,05.
Resultados
En las radiografías y en las secciones histológicas del grupo C la imagen de los tejidos periapicales se encontraba dentro de los parámetros normales (fig. 1A-B). El único dato destacable fue la aposición de gran cantidad de cemento radicular. En los maxilares del grupo E y en cada uno de los períodos de observación se detectaron áreas radiolúcidas periapicales en las raíces distales de los primeros molares inferiores (fig. 2A, C y E). Las secciones coloreadas con H-E revelaron que a los 10 días posexposición del conducto radicular la pulpa de todos los especímenes experimentales estaba necrótica, aunque aún perduraban restos de pulpa crónicamente inflamada a nivel apical (fig. 2B). A los 30 y 60 días, las pulpas se encontraban necróticas a lo largo de todo el espacio del conducto radicular (fig. 2D y F). Se detectaron también áreas de reabsorción cemento-dentinaria externa. En los tejidos periapicales se observó tejido granulomatoso compuesto por numerosas células inflamatorias, FB y fibras colágenas cuya intensidad se incrementó en función del tiempo transcurrido. En las secciones coloreadas con VMP se evidenció una destacada concentración de PL acompañada por PN, LF y MF (fig. 3).
Figura 1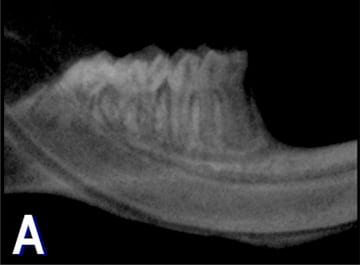
Figura 1. A: Radiovisiografía de un maxilar
representativo del grupo control en la que se
observa que las estructuras perirradiculares
del primer molar inferior se encuentran
normales.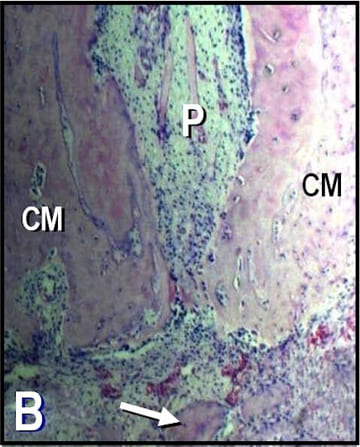
Figura 1. B: Microfotografía representativa de
la raíz distal de un primer molar inferior del
grupo control perteneciente al período
de 60 días. CM: cemento radicular; P: pulpa;
flecha: trabécula ósea. (Hematoxilina y
eosina; magnificación original X40).
Figura 2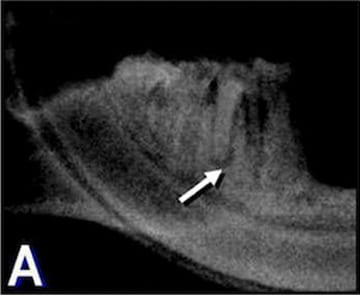
Figura 2. A: Radiovisiografía de un maxilar
representativo del grupo experimental
perteneciente al período de 10 días. La flecha
indica la presencia de un área radiolúcida
periapical en la raíz distal del primer
molar inferior.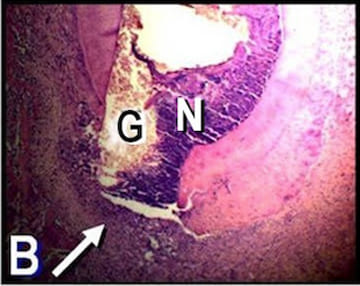
Figura 2. B: Microfotografía de la raíz distal
del primer molar de A. Se puede observar, a
nivel apical, un remanente de tejido pulpar
granulomatoso (G) y restos necróticos (N).
La flecha indica la presencia de inflamación
crónica perirradicular. (Hematoxilina y eosina;
magnificación original X100). 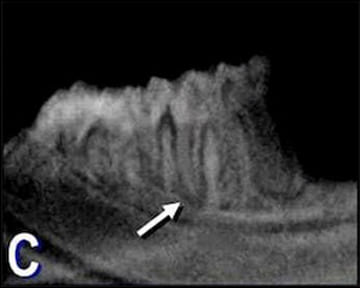
Figura 2. C: Radiovisiografía de un maxilar
representativo del grupo experimental
perteneciente al período de 30 días.
Se observa un área radiolúcida
periapical de mayor tamaño (flecha).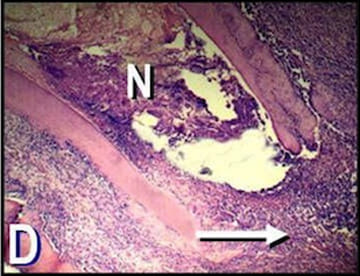
Figura 2. D: Microfotografía de la raíz distal
del primer molar de C. Se observa tejido
pulpar necrótico (N) en el conducto radicular.
La flecha indica la presencia de tejido
granulomatoso en el área perirradicular.
(Hematoxilina y eosina; magnificación
original X40). 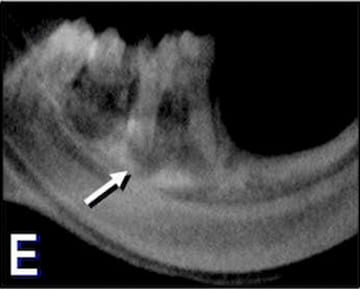
Figura 2. E: Radiovisiografía de un maxilar
representativo del grupo experimental
perteneciente al período de 60 días.
Se observa un área radiolúcida perirradicular
de gran tamaño que involucra las raíces
distal y mesial del primer molar inferior.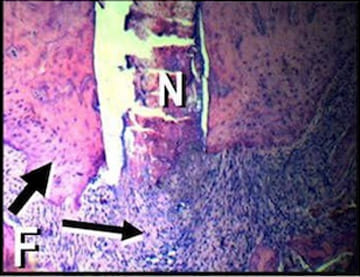
Figura 2. F: Microfotografía de la raíz distal del
primer molar de E. El tejido pulpar se
encuentra necrótico (N).
Se observa la presencia de tejido
granulomatoso perirradicular (flecha
delgada) y aposición de cemento radicular
(flecha gruesa). (Hematoxilina y eosina;
magnificación original X100).
Figura 3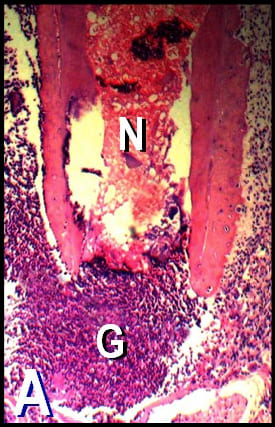
Figura 3. A: Microfotografía representativa de
la raíz distal de un primer molar del grupo
experimental perteneciente al
período de 60 días. Se observa pulpa
necrótica (N) y la presencia de un tejido
granulomatoso perirradicular (G).
(Coloración VMP; magnificación
original X40). 
Figura 3. B: A mayor aumento, se observan
plasmocitos (PL) con su citoplasma
coloreado de rojo brillante y estructuras
esferoidales hialinas en su interior
(flecha). (Coloración VMP; magnificación
original X1000).
Los resultados obtenidos se encuentran detallados en la tabla 1.
Tabla 1. Recuento de plasmocitos. Estadísticos descriptivos.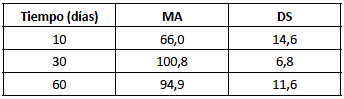
DS: desvío estándar; MA: media aritmética.
El número de PL observado a los 10 días se incrementó en un 65,47% a los 30 días pero se estabilizó, e incluso se redujo ligeramente, a los 60 días. No se registraron diferencias estadísticamente significativas (P>0,05) entre los resultados obtenidos a 30 y 60 días. Las diferencias entre estos dos períodos y los resultados correspondientes al período inicial de 10 días fueron estadísticamente significativas (P<0,05).
Discusión
En el presente estudio se investigaron la presencia y el número de PL en GPE inducidos en ratas. El modelo experimental utilizado consistió en exponer al medio oral el conducto radicular distal de los primeros molares inferiores durante diferentes períodos de tiempo (10, 30 y 60 días). En investigaciones previas, (13-18) este procedimiento ha demostrado ser eficaz para la inducción de GPE en molares de rata. El modelo es fácil de reproducir, especialmente cuando se restringe el punto de exposición pulpar a un área circunscripta de la cara oclusal.(16) En ese sentido, y a diferencia de otras investigaciones,(13-15), (17,18) la exposición pulpar fue realizada estrictamente a nivel de la fosa distal. Esta fue elegida por ser el punto de mejor acceso de la cara oclusal del primer molar inferior de la rata y, al mismo tiempo, porque facilita el ingreso en línea recta al conducto distal, evitando perforar accidentalmente el área de la furcación. La aposición de gran cantidad de cemento radicular no fue una observación inesperada, ya que constituye un fenómeno natural en la rata y su volumen suele incrementarse en función del tiempo transcurrido. El empleo de una coloración de VMP permitió identificar numerosos PL en cuyo citoplasma se observó cierta cantidad de estructuras compatibles con CHR, lo cual sugiere que estas observaciones son similares a lo que ocurre en los granulomas periapicales humanos.(7,8) El examen histológico reveló además la presencia de PN, LF y MF (datos no registrados) que también reaccionaron positivamente al VMP. Morimoto et al.(23) demostraron que los PN y MF cumplen un rol fundamental en la respuesta inmunológica del huésped, ya que producen la degradación de la matriz extracelular mediante la liberación de elastasas y otras enzimas proteolíticas. Además, fagocitan y/o destruyen bacterias por medio de sus enzimas lisosomales.
A diferencia de las observaciones de Yamasaki et al.,(16) los resultados de este ensayo revelaron que en la rata los GPE comienzan a desarrollarse aproximadamente 10 días luego de la exposición del conducto radicular; y si bien tanto la intensidad de la reacción como el número de PL se incrementaron rápidamente desde el inicio del ensayo hasta el día 30, a los 60 días la reacción se estabilizó e incluso disminuyó ligeramente hacia el final de la experiencia, lo que concuerda asimismo con las observaciones de Yang et al.(24) y Lin et al.(25)
Queda claro que el desarrollo de los GPE se produjo como consecuencia de la invasión bacteriana a través del conducto radicular expuesto al medio oral.(6,17) Yamasaki et al.(26) informaron que a los 7 días de la exposición pulpar en la rata se produce un incremento significativo de la concentración de endotoxinas bacterianas, tanto en el conducto radicular como en los tejidos periapicales. El número de endotoxinas se incrementa gradualmente hacia los 21 días y se estabiliza o decrece a los 56 días.(17,26) Estas observaciones tienden a confirmar los resultados del presente ensayo, en el que se observó el incremento de PL y otras células inflamatorias hacia los 30 días y su posterior estabilización al finalizar el experimento.
En su histórico trabajo de 1960, Welsh(27) informó acerca del rol que cumplen los PL activos en la reacción inmunológica del huésped. En este trabajo se halló que la coloración de VMP tiñe selectivamente el citoplasma de los PL de un color rojo brillante, lo que permite además destacar la posición del retículo endoplásmico y la presencia intracelular de CHR, íntimamente ligados a la liberación de inmunoglobulinas.(8)
En el presente estudio, la dinámica de los PL y de otros componentes celulares de los GPE tiende a confirmar los resultados de Xiong et al.(18) y De Rossi et al.,(28) quienes informaron que luego de exponer la pulpa de ratas al medio oral el número de células inflamatorias detectado a los 7 días se incrementa notablemente hacia los 21 y 28 días y se estabiliza a los 42 días.
En ese sentido, la función y la interacción de los PL con otras células presentes en el granuloma periapical de origen endodóntico continúan siendo aspectos de interés para los investigadores.(3) Sin embargo, a pesar de la información de que se dispone hasta el momento, la mayoría de las hipótesis al respecto continúan perteneciendo al terreno especulativo.(29)
Debe considerarse que los objetivos del presente estudio fueron orientados exclusivamente hacia la detección y la cuantificación de los PL presentes, en diferentes períodos, en GPE inducidos en ratas. Por lo tanto, los datos registrados no permiten establecer conclusiones definitivas acerca de los factores que regulan la dinámica de los PL en este tipo de patologías. El motivo por el cual la proporción y la distribución de PL se estabiliza hacia los 60 días mientras aún persiste el ingreso de bacterias a través del conducto radicular y la posibilidad de que exista una correlación directa de este fenómeno con lo que ocurre en humanos requieren ser investigados más exhaustivamente.
Conclusiones
En las condiciones en que fue realizado el presente estudio, se comprobó que, en los granulomas periradiculares inducidos en la rata, el número de plasmocitos se incrementa progresivamente desde el inicio de la exposición del conducto radicular al medio oral.
Sin embargo, y aun cuando el conducto radicular se mantuvo expuesto a la invasión bacteriana, el recuento celular tiende a estabilizarse al finalizar la experiencia, sin diferencias significativas entre las observaciones realizadas a los 30 y 60 días.
Declaración de conflicto de intereses: Los autores declaran no tener ningún conflicto de intereses en relación con este artículo científico.
Fuentes de financiamiento: Este artículo científico fue financiado exclusivamente por los autores.
Contribución de roles de autoría: OZ contribuyó en la concepción de la idea, el diseño del estudio y la redacción del artículo. CHP y ACC contribuyeron en el proceso de investigación y la recolección de los datos. OZ, CHP y ACC contribuyeron en el análisis y la interpretación de los datos. Todos los autores aprobaron la versión final para publicar.
Contacto
Osvaldo Zmener
osvaldo@zmener.com.ar
Julián Álvarez 2335 (C1425DHI)
Ciudad Autónoma de Buenos Aires, Argentina
X Twitter | WhatsApp | Facebook | E-mail

Las obras publicadas en este sitio están bajo una Licencia Creative Commons Atribución-NoComercial 4.0 Internacional















Los artículos científicos de RAOA se identifican con DOI (Digital Object Identifier) Crossref.
Visitas al artículo: 2.994

Lecturas en línea: 2.841

Descargas del artículo: 153

Accesos por DOI: 274

Database ID: 2023001001
Células inflamatorias células plasmáticas granuloma periapical rata Inflammatory cells periapical granuloma plasma cells rats





La Revista de la Asociación Odontológica Argentina, RAOA, es la principal vía de expresión de la producción científica argentina en odontología y un vínculo de unión y medio de información para los colegas e instituciones del país y del exterior.
Versión impresa ISSN 0004-4881
Versión electrónica ISSN 2683-7226.
DOI: 10.52979/raoa.1898
Título abreviado: Rev Asoc Odontol Argent